
浅谈马铃薯脱毒快繁流程步奏及配方

浅谈马铃薯脱毒快繁流程步奏及配方
马铃薯:(Solanumtuberosum)为茄科茄属作物.是全球重要的粮菜兼用作物。马铃薯具有生长期短、产量高、适应性强、营养丰富、耐储运的特点,因此深受生产和消费者的喜爱。但在马铃薯生产中普遍存在种性退化的问题,而病毒侵染是马铃薯退化的根源。由于马铃薯是无性繁殖作物,所以病毒侵染后会世代相传,危害逐年加重。目前,******上公认的解决马铃薯病毒危害,防止品种退化的有效途径是茎尖离体培养。通过茎尖离体培养培育脱毒基础苗,再通过建立合理的良种繁育体系生产优良种薯是马铃薯高产、稳产、优质的可靠保证。

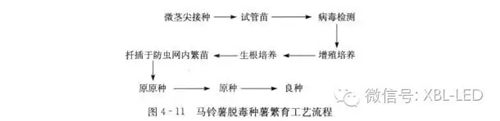
一、脱毒种薯繁育工艺流程
马铃薯脱毒种薯繁育工艺流程如图所示。
二、脱毒技术
2.1 脱毒方法
2.1.1 外植体选择及处理
外植体的选择途径一般有3条:①在生长季节从田间挖取植株种植在无菌的盆土中,温室内栽培,取其新长成枝条的芽;②从田间切取枝条,插入营养液中生长,取新抽生枝条上的芽;③块茎在室内发芽,芽经热处理(38℃)2周后再取芽。另外,定期给植株喷施内吸******剂,如0.1%多菌灵和0.1%链霉素的混合液,可以有效提高******效果。经过上述处理之后,要比直接取自田间枝条污染少得多。再加上茎尖分生组织又被彼此重叠的叶原基保护.只要仔细剥取,无须再进行******,就能得到无菌的外植体。但为保险起见,在切取外植体之前,可以先进行简单的表面******,一般在5%次氯酸钠中处理8~10min即可。虽然顶芽和腋芽都能作为外植体,但顶芽的茎尖生长要比腋芽的快,成活率也高,所以一般取顶芽作为外植体。

2.1.2 剥离茎尖和接种
在超净台上的解剖镜(8~40倍)下进行茎尖剥离。解剖时必须注意使茎尖暴露的时间越短越好.以免超净台的气流风干茎尖。在材料下垫上一块湿润的无菌滤纸也可达到保持茎尖新鲜的目的。在解剖镜下用解剖针将叶片和叶原基剥掉,直到露出圆亮的茎尖生长点。将带有l~2个叶原基的茎尖切下.接种到培养基上。要注意防止交叉污染,尤其是当芽未曾进行过表面******时更要谨慎。
2.1.3 培养
对马铃薯茎尖培养来说,MS和white基本培养基都是较好的培养基,而且附加少量(0.1~0.5 mg/L)的NAA或BA或二者都加,培养效果更好。只有生长点的极小茎尖的培养******采用液体培养,多放在滤纸桥上培养。

茎尖培养初期的***适光照强度为1000lx,4周后增加到2000 lx,6周后增加到4000lx。培养温度21~25℃,光照时间以16h/d为宜。1个月左右茎尖再生成有可见小叶的小植株,保存部分原苗,准备扩繁用;另一部分用于病毒检测。茎尖培养时需要注意以下3个问题:①茎尖接种后基部无明显膨大,茎尖变绿,成绿色小点,这是******浓度或温度偏低造成的;②接种后茎尖明显膨大,3~5d可见淡绿色愈伤组织,这是由于******浓度或温度偏高,光照偏弱造成的。③培养基添加0.8 mg/L的GA有利于茎尖的成活和促长,但不要浓度过高或作用时间过长,否则会使茎尖不易转绿,导致叶原基迅速伸长,生长点并不生长,整个茎尖变褐而死。
2.2 脱毒效果检测
马铃薯经过茎尖培养脱毒后,只有部分植株是脱病毒植株。因此,在用作脱病毒原种苗之前,必须进行病毒检测证明无病毒后才能推广。在繁殖中还要不断重复检测,以防重新感染。常用的病毒鉴定方法有指示植物测定法、血清学方法和电子显微镜法。

三、脱毒苗快繁技术
3.1 继代培殖与生根培养
将经鉴定******的马铃薯脱毒苗,采用固体与液体培养基相结合的方法进行继代增殖培养效果好。取试管苗单节切段扦插在MS固体培养基上,每瓶可插20个左右茎段,经20d左右便可发育成5~10cm高的小植株,然后进行切段繁殖。此法速度快,每月可繁殖5~8倍。如果多茎节的试管苗接种在液体培养基上,进行浅层静止液体培养,则比固体培养基生根快,长得粗壮。便于栽植,同时省去大量琼脂,降低了生产成本,同时提高了试管苗成活率。培养基可选用MS培养基,其中的烟酸、肌醇都可以减去,琼脂浓度也可降低。在25~28℃、光照强度3000~4000lx、连续光照的条件下,切段繁殖速度很快,一般每月能增加7~8倍。
另外,也可将1~2cm高的苗转人MS、IAA 0.1~0.5 mg/L,活性炭0.1~0.2g/L的生根培养基中培养,7~10d生根。

3.2 驯化移栽
为增强试管苗对温室内环境条件的适应能力,移植前对试管苗要进行光、温锻炼。具体方法是:移植前7d左右,将长有3~5片叶、高2~3cm的试管苗瓶摆放在温室内的驯化畦内,畦内浇上水,畦上方半遮阳进行驯化,以防止强光、高温灼伤试管苗和维持试管苗周围的温度。移至温室的试管苗,尽管仍处于封口的瓶内,但由于封口膜透气性好,瓶内的湿度下降,使试管苗的茎叶变硬,加上光照增强,茎秆变粗,叶片肥厚浓绿,有效地抑制了徒长和******的侵染,从而提高了试管苗的抗逆性和对环境条件变化的适应能力,提高了移栽成活率。炼苗期温室内的温度一般要求白天23~27℃,夜间不低于10℃。
移栽方法采用单芽茎段或双芽茎段扦插式移栽。边剪取边扦插。扦插基质可采用灭过菌的珍珠岩或疏松土壤。扦插成活后每隔2~3d喷1次营养液(表4-5),后期每隔10d喷一次,以促进扦插苗健壮和顺利结薯。

四、微型薯生产技术
由试管苗生产的重l~30g的微小马铃薯称为微型薯。虽然温室或实验室内都可以诱导产生微型薯,但以实验室内诱导生产为主,为马铃薯的种质保存、交换以及脱毒种薯的繁育和运输提供了一种便利的途径,也便于马铃薯种薯的大面积推广。

4.1 实验室生产微型薯
组织培养生产微型薯要求条件较严格,费用较高,但产品的质量好,整齐度高,粒重一般只有1~5g,由于是在三角瓶中或试管中培养,因此可作为不带病原菌的原种使用,或作为基础研究材料和病原鉴定的实验材料。实验室微型薯生产(图4—12)一般分单茎段扩大繁殖和微型薯诱导两个阶段。
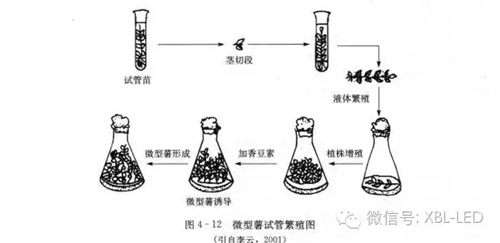
4.1.1 单茎节扩大繁殖
从试管苗中获得茎切段,每个切段上带有1~2个叶片和腋芽。每个三角瓶中接4~5个茎段进行培养。培养条件是温度22℃、光照16h/d、光照强度1000lx。所采用培养基:①节段培养基,MS、3%蔗糖、0.8%琼脂;②液体振荡培养基,MS、2%蔗糖;③微型种薯诱导培养基,MS、香豆素50~100 rag/L;④离体保存培养基,MS、3%蔗糖、4%甘露醇、0.8%琼脂。在此条件下,由腋芽形成的小植株生长很快,当小植株长到4~5 cm时,就可以进行第二步培养。
4.1.2 微型薯诱导
微型薯要求有一定量的******,并且要在黑暗条件下培养。采用廉价的香豆素代替CCC和BAP,用食用白糖代替蔗糖,同样结薯很好。采用MS、香豆素50~100 mg/L的液体或固体培养基。培养基的液固状态和光照条件对微型薯诱导有很大作用。与单茎节扩大繁殖不同,微型薯的诱导必须在黑暗条件下进行,否则只有植株生长,而没有小薯形成。培养温度22℃。

4.2 温室生产微型薯
一般采用脱毒苗切繁方法进行。为了节约土地,充分利用空间,有人专门设计了温室多层架盘工厂化生产微型薯的方法。具体方法是:在温室4~6层育苗架上放育苗盘,基质可以是蛭石、珍珠岩等。将脱毒试管苗以单茎段或双芽芽茎段扦插,然后在人工调控的温光条件下经60~90d即可收获微型薯。扦插时用GA3mg/L、NAA5mg/I。的混合液浸泡茎段,扦插成活率达98%。
五、原种种薯和生产种薯生产技术

在实验室或温室生产的微型薯(原原种),可进一步通过大田或塑料大棚在春秋两季扩大繁殖,生产原种种薯。利用原种种薯切块播种,生产出生产种薯,用于马铃薯栽培用种。原种和生产种的种薯生产要求在保护地设施内进行,以下介绍原种生产技术。
选3~4年未种过马铃薯的土地,精细整地后搭棚。拱棚可采用30m×50m或25m×8m的规格或直接在温室内生产。播种前浇水,施有机肥4000~5000 kg/亩,并用过磷酸钙20~25kg或硫酸钾15~20kg/亩的一半作基肥,另一半留在马铃薯现蕾期结合培土施用。微型薯原原种在播种前须用湿沙埋住,在室内散射光下催芽。由于休眠的影响,必须等芽萌动后才能播种,这是保全苗的关键。微型薯大小不一致时分级播种。原种生产要求高密度播种(行株距:50cm×10cm或60cm×10cm),要求单株结薯多,以5~10g的单薯重为宜。春季防治早疫病,秋季防治晚疫病,在温室或拱棚内扣防虫网室,防止蚜虫传播病毒。在整个生长期要注意拔除杂草和菌株。预防病害传播,以提高种薯纯度和质量。秋季播种时要对晚熟品种进行打破休眠处理(早熟品种可自行通过休眠)。具体方法是在播前10~15d进行切块,晾干后喷10~50mg/L的GA溶液,并用湿麻袋或塑料薄膜保湿,以打破休眠。另外,温室生产种薯要注意早收。采收后及时晾晒,待表皮干燥后再进行窖藏。
